前言
CAR-T细胞治疗中,体内T细胞持久性和优良的临床结果之间有一定的相关性,今天小编引用的研究表明了采用CAR-T细胞培养物的补充而不需要额外的基因修饰对改善CAR- T细胞制造的重Yao性,探索了人血衍生制品作为培养基补充剂培养CAR-T细胞对CAR-T细胞表型的影响,发现用hPL作为一种GMP级的培养补充剂替换传统的FBS或ABS血清,可在T细胞在TN期和TCM期一定程度上阻止CAR-T细胞分化,为产品细胞治疗制剂产品中获得较低分化表型的细胞同时在体内外与靶细胞长时间共培养的实验情况下展示了良好的抗肿瘤效应。
Part 1
1.1 CAR-T细胞在hPL体外培养体系中获得维持低分化T细胞表型
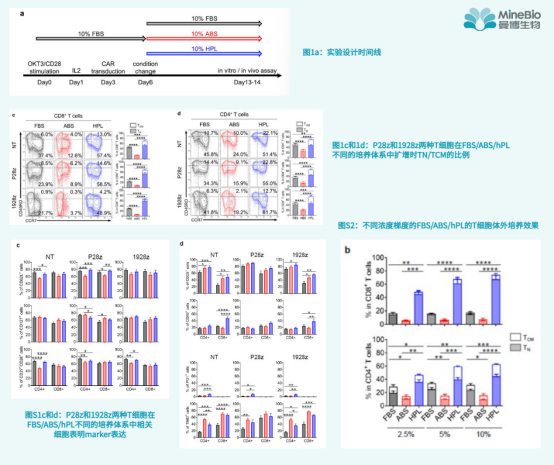
为了评估细胞体外扩增阶段不同人血衍生物对CAR - T细胞功能的影响,研究者首先将在添加10%胎牛血清的培养基中培养的OKT3/CD28刺激的T细胞,使用表达第二代前列腺干细胞抗原(PSCA)或CD19特异性CAR(含内结构域CD28和CD3z)的逆转录病毒载体转导此T细胞获得分别为P28z和1928z的两种T细胞。转导后3天T细胞培养被分成三种组分别是:添加10%胎牛血清、添加10% ABS以及添加10% hPL的培养基中培养扩增1周(图1a)(本实验中每组都添加了相同量的IL-2)。
扩增结果发现这三组培养补充剂中T细胞扩增总体无统计学差异。然而当检查扩增细胞的表型图谱时,hPL中培养组中的细胞显示在CD8*和CD4* T细胞部分中代表初始T(TN)和中央记忆T细胞(TCM)的CCR7*细胞比例更高(图1C和D)。
此外,还探索了与记忆(CD62L, CD127, CD27和CD28)、激活(CD25和CD69)和抑制(PD1和TIM3)相关的其他细胞表面marker的表达。hPL扩增的细胞中CD25、CD69、PD1和TIM3的表达增加,而ABS扩增的细胞中CD25、CD69、PD1和TIM3的表达降低((图S1d), 而在ABS中扩增的细胞在CD8+和CD4+ T细胞亚群中CD62L+表达较低,以及非转导T细胞(NT)、P28z和1928z中CD4* T细胞中CD27*CD28*群体数量的减少(图S1c)。
研究者也发现较低的hPL浓度(低至2.5%)也不会破坏T细胞的生长或表型,不像FBS在浓度低于5%会阻碍T细胞的扩增(图S2)。
研究者进一步的通过RNAseq分析(第7天更换培养基)p28z修饰细胞的特性,发现细胞在hPL培养组的细胞群中高表达TN /TCM相关基因如LEF1、FOXP1和KLF1以及较少的效应T细胞(TE)相关基因编码转录因子如TBX21、eoms和KLRG1以及效应分子如粒酶、穿孔素和IFNy。
因此,根据以上表型和基因表达谱相关研究结果,在hPL中扩增的T细胞培养物有利于具有TN/ TCM特征的细胞亚群的扩增的趋势。
1.2 TGFβ1在维持低分化CAR - T细胞表型方面的影响和作用
以上两种不同CAR模型的研究中,由于hPL培养组的T细胞优于ABS或FBS对应的T细胞,所以研究者试图确定影响T细胞表型的成分。
首先实验人员对ABS和hPL进行了人类蛋白质组学分析,发现与ABS相比hPL含有更高水平的转化生长因子β1 (TGFβ1)。由于之前的研究发现TGFβ1可以阻止T细胞分化,促进活化和记忆T细胞的存活[参考文献1-3],因此初步判断TGFβ1对维持低分化T细胞表型有一定的影响。
为了探索TGFβ1对记忆T细胞表型的特异性影响,继续在FBS和ABS培养物中添加重组TGFβ1 (5 ng/mL),使其水平正常化到10% hPL培养物中相当的水平。作为额外的对照,使用转基因表达显性阴性TGFβ受体II (DNRII)的T细胞来中和hPL中的TGFβ1。有趣的是,通过TGFβ1的补充,实验者观察到FBS和ABS培养中CCR7+细胞的比例更高,而DNRII T细胞的替代消除了hPL对CCR7表达的影响。因此借助重组TGFβ1实验证实发现TGFβ1对T细胞有免疫抑制作用但是这种外源性补充的TGFβ1对CAR - T细胞的细胞杀伤溶解能力有不利影响,而hPL培养组的CAR - T细胞的表型和功能特征可能是多种可溶性蛋白的结果,TGFβ1可能是其中之一。
Part 2
体外长期共培养实验中,hPL培养的CAR - T细胞显示出更高的增殖能力,导致了强大的抗肿瘤效应。
上文中提到hPL培养的TN和TCM亚群在抗原刺激下比TE具有更高的增殖能力[1C和1D]。因此,实验人员用CellTrace Violet染料(CTV)标记每种实验条件下的P28z或1928z T细胞,然后分别用Capan-1PSCA或NALM6细胞刺激它们。培养5天后,我们基于CTV稀释和CAR - T细胞凋亡(Annexin V和7AAD染色)评估细胞增殖。如图3a所示,hPL扩增的P28z和1928z T细胞在抗原刺激下细胞分裂数量显著增加,凋亡减少(P28z - Annexin V+凋亡细胞:FBS - 52.1±7.2%,ABS - 59.4±2.9%,hPL- 26.7±3.4%,平均±S.E. n = 5;1928z - FBS - 80.0±2.4%,ABS - 74.9±1.7%,hPL - 41.3±2.9%,平均±标准差,n = 5)(图3b)。
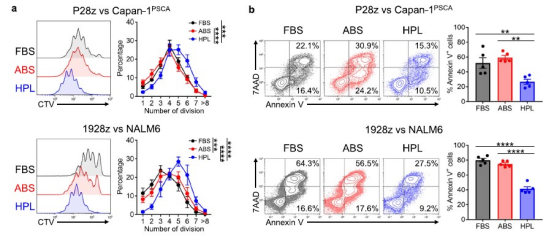
图3a&3b:FBS/ABS/hPL组CAR - T细胞增殖和抗肿瘤反应的影响:P28z或1928z T细胞用CTV染色,分别与Capan-1PSCA或NALM6共培养5天,使用CellTrace Violet (CTV)进行细胞增殖试验和检测凋亡细胞。
由于本次研究中观察到hPL扩增的CAR - T细胞的短期细胞毒性减弱但增殖能力增强,实验人员接下来评估了由细胞增殖及其细胞毒性效应影响T细胞治疗的长期体外抗肿瘤效果。因此继续进行了一个9天的体外共培养实验,同时监测肿瘤细胞的杀伤和T细胞的扩增情况。
P28z T细胞与Capan-1PSCA共培养结束时,hPL培养的P28z T细胞具有较强的抗肿瘤活性,各组的详细数据为:1)肿瘤细胞倍增率:FBS - 1.4±0.5,ABS - 1.9±0.8,hPL- 0.4±0.2,平均±S.E. n = 6;T细胞倍增率:T细胞倍增率:FBS - 5.6±3.2,ABS - 5.7±1.7,hPL- 24.7±3.7,平均±S.E. n = 6)(图3c)。
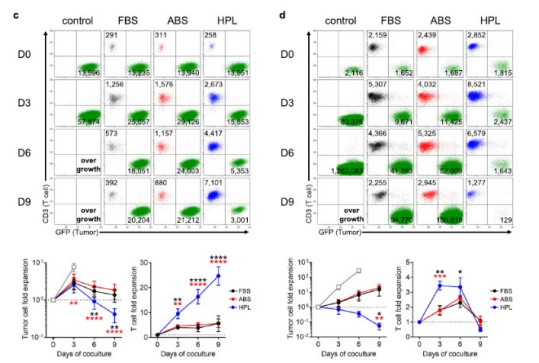
图3c&d:体外长期共培养实验-P28z T细胞与Capan-1PSCA细胞共培养(c)或1928z T细胞与NALM6细胞共培养(d) 9天,每3天收集细胞,用流式细胞仪计数。
同样地,hPL培养的1928z T细胞比其他血清条件下的增殖更快、更健壮,第3天细胞扩增情况数据为:FBS - 1.8±0.3,ABS - 1.8±0.3,hPL - 3.4±0.3,平均±S.E. n = 6,第9天NALM6消除的数据为:肿瘤细胞扩增倍数:FBS - 15.5±10.0,ABS - 20.2±14.7,hPL - 0.06±0.03,平均±S.E. n = 6)(图3d)。
总之,长期体外T细胞与肿瘤细胞共培养实验中,由于hPL培养的CAR - T细胞更高的增殖能力其整体杀伤肿瘤效果优于在FBS或ABS中扩增的CAR - T细胞。
Part 3
3.1 hPL扩增的P28z T细胞在体内抗肿瘤作用增强
为了评估在不同人血衍生物作为补充剂的培养条件下的CAR - T细胞在体内的抗肿瘤作用,我们将Capan-1PSCA细胞移植到小鼠体内,然后在肿瘤达到100mm³(大概肿瘤植入后21天的预估尺寸)时,静脉注射GFP/ FL标记的P28z T细胞(图4a)。有趣的是无论培养条件如何,我们观察到肿瘤部位P28z T细胞的扩增水平相似(图4b)。然而,当我们通过caliper测量评估每只小鼠的Zui大抗肿瘤反应时(从T细胞治疗后的第10天到第35天),hPL培养组的P28z T细胞治疗的动物有更好治疗结果(hPL;38 + 22 mm3, 9/12无肿瘤,FBS;81 + 19 mm3, 1/12无肿瘤,ABS;104 + 27 mm3, 2/12无肿瘤,平均+下颌骨,n =12)(图4c)。在CAR - T细胞治疗后的第112天跟踪各组肿瘤复发情况,发现3只小鼠仍没有肿瘤(图4d和e),而那些复发的小鼠在稍后复发,是抗原阴性复发的结果(附加文件2:图S4)。
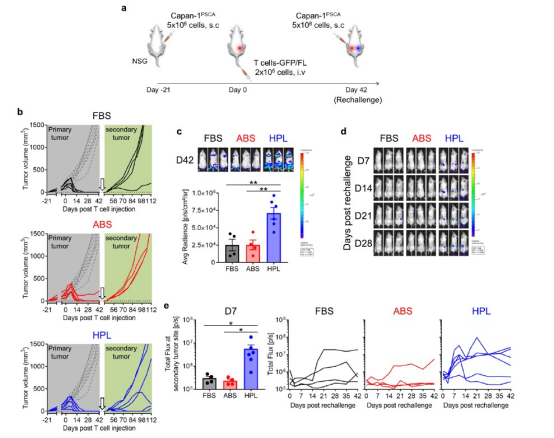
图5 P28z T细胞持久性及对肿瘤再发模型的抗肿瘤作用
进一步研究在体内hPL培养组的细胞是否表现出更好的持久性和保护能力,实验人员进行了一个肿瘤复发模型实验,在该模型中对清除原发肿瘤的小鼠[在给药高剂量T细胞(2 × 106个T细胞/只小鼠)后,在对侧腹部用移植入相同的肿瘤细胞 (图5a)。在CAR - T细胞治疗42天后,我们观察到多数动物已经消除了它们的原发肿瘤(FBS;5/5, ABS;5/6, hPL, 6/6)(图5b,灰色背景)。如图5b(浅绿色背景)所示: P28z (hPL) T细胞处理的小鼠肿瘤生长延迟 (2/6)或完全消除肿瘤(2/6) ,而P28z (FBS) T细胞处理的小鼠仅1/4小鼠肿瘤生长延迟 ,而P28z (ABS)小鼠则无对照区别。我们还正式评估了T细胞在肿瘤再发模型实验中的持久性,并发现P28z (hPL) T细胞的生物发光显Zhu更高(图5c),表明原发肿瘤消除后的维持的持久性更长。这些P28z T细胞能够迁移到新的肿瘤部位扩增并产生细胞毒性(图5d和5e),从而延缓肿瘤生长或消除肿瘤。
3.2 hPL扩增的1928z T细胞在体内表现出更高的增殖能力和消除NALM6肿瘤能力
为了研究hPL培养的CAR- T细胞的抗肿瘤效果是否超出了Capan-1PSCA模型,研究者继续进行了第二个异种移植小鼠模型,通过GFP/FL+ NALM6细胞移植小鼠(i.v),然后(3天后)输注1928z T细胞(5 × 106细胞/小鼠,i.v)(图6a)。结果发现使用FBS或ABS培养的细胞治疗的小鼠在随后不久复发,而使用hPL法培养的CAR - T细胞治疗的小鼠产生了较长的无瘤生存期(图6c和d),这与T细胞治疗后第8天和第13天的优势T细胞数量有关(图6e)。由于NALM6肿瘤细胞优先定位于骨髓和次生淋巴样器官(图6b),实验者也通过将GFP/FL转导的1928z T细胞输注到NALM6小鼠中来追踪T细胞的迁移和扩增情况(图6f)。
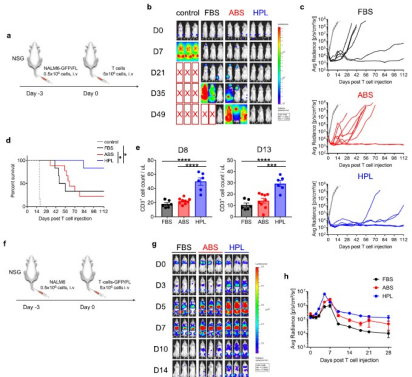
图6 1928z T细胞在FBS/ABS/hPL中扩增后的体内表现
如图6g所示,1928z (hPL) T细胞在疾病部位快速且健壮地扩增,并且比FBS或ABS中1928z T细胞扩增的时间更长(图6h)。这些发现在高T细胞剂量下得到了重现(附加文件2:图S6)。总之这些数据表明CAR - T细胞在hPL中的体外扩增中增强了CAR - T细胞的功能。
结论
与FBS或ABS相比,hPL培养体系的CAR - T细胞表现出更高增殖能力和增强的长期体内持久性,从而产生更好的抗肿瘤效果。这些数据证明了hPL可用于制备临床级别的CAR - T细胞产品供患者治疗使用。值得注意的是,hPL来自多个可输血供者的血小板,起初开发的目的是支持MSCs的体外扩增,用于临床包括GVHD、克罗恩病、肌萎缩性侧侧症和多发性硬化症等一系列自身免疫性疾病的治疗。因此这篇研究是早期Di一批评估hPL作为培养基补充剂对CAR - T细胞表型或功能影响的研究之一。
更多hPL血小板裂解液相关产品问题,欢迎咨询上海曼博生物!
郑重声明:本文版权归原作者所有,转载文章仅为传播更多信息之目的,如作者信息标记有误,请第一时间联系我们修改或删除,多谢。
